Estrategias de terapia génica (TG) en el SNCLa terapia génica se define como la modificación genética de células para producir un efecto terapéutico.
Existen dos maneras de transferir los genes terapéuticos en los tejidos: a) la TG ex-vivo (transplante de células que han sido previamente genéticamente modificadas) y b) la transeferencia directa in-vivo del material genético al cerebro.
La TG ex-vivo usualmente es designada para actuar como una bomba biológica que suministra diferentes sustancias difusibles: neurotrasmisores o factores neurotróficos.
El suministro de genes in vivo (TG in-vivo) permite la intervención directa en los procesos endógenos intracelulares. Puede emplearse para bloquear directamente la producción o función de proteínas patológicas mediante la expresión de proteínas negativas dominantes, ARNs antisentido o pequeños ARN interferentes.
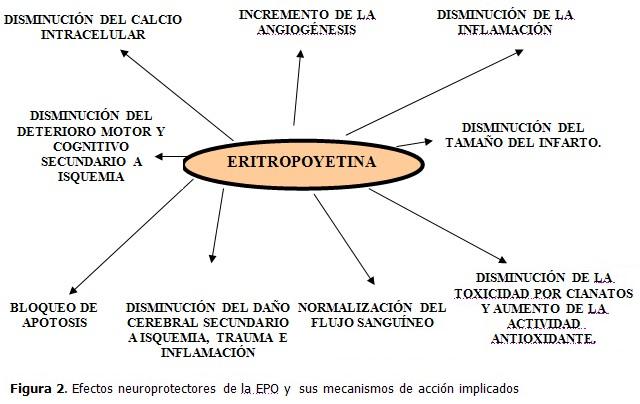
Terapia génica mediada por vector rAAV para ECV isquémica experimental
El sistema de vector viral más seguro para la terapia génica se basa en virus adeno-asociado recombinante (rAAV) el cual se a desarrollado y aplicado en la terapia genética del ictus isquémico.
El vector rAAV ha hecho grandes progresos en la mejora de la entrega de genes mediante la modificación de la cápside y el aumento de la expresión del transgén por encapsidación del genoma de doble cadena rAAV.
Bibliografía:
rAAV vector-mediated gene therapy for experimental ischemic stroke
Estrategias terapéuticas genéticas de interés en psiquiatría. (este artículo no está disponible gratuitamente)